Вода. Водородная связь. Ни одна из планет Солнечной системы не содержит на
своей поверхности такого большого количества воды, как наша Земля. Моря и
океаны, средняя глубина которых около 6 км, покрывают 71 % поверхности
Земли. Огромное количество воды в виде снега и льда сосредоточено в
приполярных районах. Этот удивительный факт пока не нашел однозначного
объяснения. Безусловно, вода играет огромную роль в возникновении и
существовании жизни на нашей планете. Во многом это связано со
свойствами, которых нет у ее ближайших соседей и аналогов (H2S, H2Se
и т.д.)
Прежде всего нужно
разобраться, почему вода может находиться в жидком и даже в твердом
состоянии (лед) в условиях, в которых похожие соединения водорода с
более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее строение:
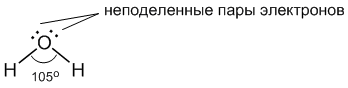
Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные
пары электронов тоже играют важную роль в свойствах воды. Все
заместители у атома кислорода, включая неподеленные пары, стремятся
расположиться как можно дальше друг от друга. Это
приводит к тому, что молекула приобретает форму искаженного тетраэдра с
атомом кислорода в центре. В четырех вершинах этого "тетраэдра"
находятся два атома водорода и две неподеленные пары электронов. Но если
смотреть только по центрам атомов, то получается, что молекула воды
имеет угловое строение, причем угол Н–О–Н составляет примерно 105
градусов.
Для возникновения водородных связей важно, чтобы в
молекулах вещества были атомы водорода, связанные с небольшими, но
электроотрицательными атомами, например: O, N, F. Это создает заметный
частичный положительный заряд на атомах водорода. С другой стороны,
важно, чтобы у электроотрицательных атомов были неподеленные электронные
пары. Когда обедненный электронами атом водорода одной молекулы
(акцептор) взаимодействует с неподеленной электронной парой на атоме N, O
или F другой молекулы (донор), то возникает связь, похожая на полярную
ковалентную.
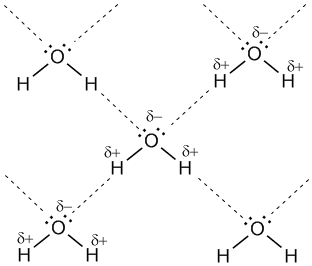
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром).
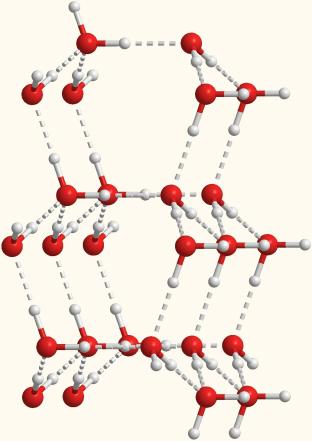
Рис. 7-1б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
Учитывая заметную разницу зарядов на атомах Н и О
соседних молекул, дополнительную прочность этой межмолекулярной связи
придает притяжение разноименных зарядов. Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
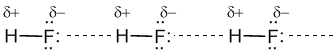
 В
водных растворах аммиака или HF эти молекулы образуют водородные связи
не только между собой, но и с молекулами воды. Благодаря водородным
связям аммиак NH3 имеет фантастическую растворимость: в 1 л
воды может растворяться 750 л газообразного аммиака! В органических
веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на пространственную форму этих молекул.
В
водных растворах аммиака или HF эти молекулы образуют водородные связи
не только между собой, но и с молекулами воды. Благодаря водородным
связям аммиак NH3 имеет фантастическую растворимость: в 1 л
воды может растворяться 750 л газообразного аммиака! В органических
веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на пространственную форму этих молекул.
Энергия связи водородной связи Н---О в димере воды (H2O)2
составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи
более длинные и примерно в 10-20 раз менее прочные, чем обычные
ковалентные, но именно они заставляют воду быть жидкостью или льдом (а
не газом) в обычных условиях. Водородные связи разрушаются только тогда,
когда жидкая вода переходит в пар.
При температурах выше 0 °С (но ниже температуры
кипения) вода уже не имеет такую упорядоченную межмолекулярную
структуру, как показано на рисунках 7-1а и 7-1б. Поэтому в жидкой воде
молекулы связаны между собой лишь в отдельные агрегаты из нескольких
молекул. Эти агрегаты могут свободно двигаться рядом друг с другом,
образуя подвижную жидкость. Но при понижении температуры упорядоченность
становится все больше и больше, а агрегаты – все крупнее. Наконец,
образуется лед, который имеет примерно такую упорядоченную структуру,
как на рис. 7-1б и 3-15 из §3.8.
Кстати, на этих рисунках хорошо видно, что в
кристалле льда между молекулами остаются пустоты. Объем пустот чуть
больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет
меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство
же других веществ при замерзании увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно
уникальное свойство, без которого вряд ли могла бы существовать
разнообразная жизнь в тех районах Земли, где температура зимой
понижается ниже 0 °С. Если бы лед тонул в воде, то зимой все водоемы
промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы
жить в таких условиях. Человек мог бы растапливать лед, превращая его в
воду для своих нужд, но это потребовало бы огромных затрат
дополнительной энергии.

** Еще одно красивое проявление водородных связей –
голубой цвет чистой воды в ее толще. Когда одна молекула воды
колеблется, она заставляет колебаться и связанные с ней водородными
связями другие молекулы. На возбуждение этих колебаний расходуются
красные лучи солнечного спектра, как наиболее подходящие по энергии.
Таким образом, из солнечного спектра "отфильтровываются" красные лучи – их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
В белом солнечном свете различные цвета как бы уравновешивают друг друга. Поэтому солнечный свет кажется глазу "белым" – лишенным цвета. Если "отфильтровать" лучи одного участка спектра, то начинает проступать другой –
в данном случае голубой участок спектра. Он и окрашивает воду в
красивый голубой цвет. Но для этого требуется, чтобы солнечный луч
прошел не менее чем через 2-х метровую толщу чистой воды и "потерял"
достаточно много красных лучей.
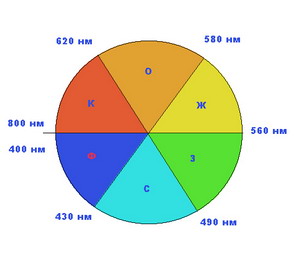
Понять механизм восприятия цвета нашими глазами может
помочь "круг цветов", используемый художниками и показанный на рисунке.
Цвета в нем расположены в следующем порядке (по часовой стрелке):
красный, оранжевый, желтый, зеленый, синий, фиолетовый. Цвет,
возникающий при поглощении какого-либо цвета из белого, называют дополнительным.
В "круге цветов" дополнительными по отношению друг к другу являются,
например, красный и зеленый. Или оранжевый и синий, то есть те цвета,
которые находятся в секторах напротив друг друга.
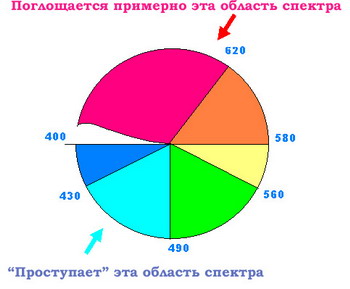
Обычно человеческий глаз воспринимает свет с длиной волны от 800 нм (пурпурно-красный) до 400 нм (темно-фиолетовый). "Круг
цветов" достаточно условен, так как строгой границы между цветами нет.
Существует множество оттенков и порой трудно определить, где
заканчивается, например, желтый цвет и начинается зеленый. Но условно
эти границы можно провести примерно так, как показано на следующем
рисунке. Поэтому если какое-нибудь вещество (в нашем случае – вода)
поглощает из солнечного спектра красные лучи, то поток света, прошедший
через это вещество (или отраженный от его поверхности), обогащается
дополнительным цветом – голубым. Разумеется, для этого необходимо, чтобы
вода была чистой и не содержала веществ, поглощающих лучи из других
участков спектра. Очень загрязненная вода поглощает практически весь
видимый свет и выглядит черной.
Химические свойства воды. Давайте вспомним
все уже известные нам реакции, в которых участвует вода. Для этого вновь
напишем уравнения встречавшихся ранее реакций и систематизируем их.
Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут
участвовать в окислительно-восстановительных реакциях этого типа.
Наиболее легко реагируют щелочные и щелочноземельные металлы I и II
групп.
Из неметаллов с водой реагируют, например,
углерод и его водородное соединение (метан). Эти вещества гораздо менее
активны, чем металлы, но все же способны реагировать с водой при высокой
температуре:
C + H2O = H2 + CO (при сильном нагревании)
CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании)
2) Вода разлагается на водород и кислород при
действии электрического тока. Это также окислительно-восстановительная
реакция, где вода является одновременно и окислителем, и
восстановителем:

3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
SO2
|
+
|
H2O
|
=
|
H2SO3
|
сернистая кислота
|
SO3
|
+
|
H2O
|
=
|
H2SO4
|
серная кислота
|
CO2
|
+
|
H2O
|
=
|
H2CO3
|
угольная кислота
|
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
CaO
|
+
|
H2O
|
=
|
Ca(OH)2
|
гидроксид кальция (гашеная известь)
|
 5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
CuSO4
|
+
|
5 H2O
|
=
|
CuSO4.5H2O
|
вещество белого цвета (безводный сульфат меди)
|
кристаллогидрат (медный купорос), синие кристаллы
|
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и
кристаллогидраты, используют в качестве осушителей. С их помощью,
например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Задачи
1. Напишите уравнения реакций следующих превращений: Ca→CaH2→
Ca(OH)2 .
2. Определите число молекул кристаллизационной воды в кристаллогидрате сульфата алюминия Al2(SO4)3×
nH2O, если в 6,66 г этого соединения содержится 1,806×
1023 атомов кислорода.
Источник: http://www.hemi.nsu.ru/ucheb174.htm

Комментариев нет:
Отправить комментарий
Примечание. Отправлять комментарии могут только участники этого блога.