 Классическую
электронную теорию химической связи предложил в 1916 г. американский
химик Гилберт Ньютон Льюис (1875—1946). Как уже было известно,
завершённые электронные оболочки атомов благородных газов отличаются
особенной устойчивостью. Льюис предположил, что при образовании
химической связи возникают пары электронов, которые принадлежат сразу
двум атомам. Тем самым атомы заполняют до конца свой внешний
электронный уровень и приобретают электронную конфигурацию благородного
газа. Льюис назвал это правилам октета, так
как атомы всех благородных газов (кроме гелия) имеют на внешнем уровне
восемь электронов. С помощью правила октета удалось объяснить
электронное строение огромного числа соединений. А связь, образованная
за счёт общей пары электронов, получила название ковалентной.
Классическую
электронную теорию химической связи предложил в 1916 г. американский
химик Гилберт Ньютон Льюис (1875—1946). Как уже было известно,
завершённые электронные оболочки атомов благородных газов отличаются
особенной устойчивостью. Льюис предположил, что при образовании
химической связи возникают пары электронов, которые принадлежат сразу
двум атомам. Тем самым атомы заполняют до конца свой внешний
электронный уровень и приобретают электронную конфигурацию благородного
газа. Льюис назвал это правилам октета, так
как атомы всех благородных газов (кроме гелия) имеют на внешнем уровне
восемь электронов. С помощью правила октета удалось объяснить
электронное строение огромного числа соединений. А связь, образованная
за счёт общей пары электронов, получила название ковалентной.
Для
обозначения электронов Льюис использовал точки: Н:Н. Но часто общую
пару электронов изображают просто чёрточкой, которая и символизирует
химическую связь: Н—Н. В молекуле Н2 каждому атому
принадлежат два электрона (конфигурация атома гелия), которые
предоставлены в общее пользование двумя атомами водорода (это обменный механизм образования ковалентной связи).
Подобным образом устроена и молекула F2. У
атома фтора на внешнем уровне семь электронов — чтобы достичь
электронной конфигурации неона не хватает одного. Поэтому каждый атом F отдаёт по одному электрону в общее пользование:
Теперь
оба атома имеют на внешнем уровне по восемь электронов (октет), из
которых два общих, а шесть (три пары) сохраняются в индивидуальном
пользовании.
Аналогично образуются и кратные связи. Так, тройная связь в молекуле N2 (NºN) возникает в результате создания трёх общих электронных пар.
В двухатомных молекулах простых веществ (Н2, F2, N2 и др.) общие пары электронов в равной степени принадлежат обоим атомам. Такая связь называется непопярной. При
образовании ковалентной связи в молекулах сложных веществ общая
электронная пара оказывается смещённой в сторону одного из атомов.
Молекула при этом поляризуется: одна её часть несёт частичный
положительный заряд (8+), а другая — отрицательный (8-). Примером может
служить молекула HF, в которой атом Н достигает электронной конфигурации гелия, а атом F — неона:
Общая электронная пара в этом соединении смещена в сторону атома фтора. Это пример полярной связи.
Бывает,
что один из атомов (донор электронов) предоставляет в общее пользование
два электрона, а другой (акцептор) — ни одного. Такой механизм
образования ковалентной связи называют донорно-акцепторным (иногда эту связь обозначают стрелкой, направленой к акцептору).
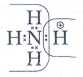
Пример
— ион аммония. Атом азота имеет три неспаренных электрона, которые
участвуют в трёх ковалентных связях с тремя атомами водорода. Кроме
того, у атома азота есть ещё одна пара электронов. При присоединении
иона Н+ к аммиаку NH3 эта
пара поступает в совместное пользование атомов азота и водорода. В
данном случае атом азота выступает в качестве донора, а Н+ — акцептора электронной пары:

В
молекуле С=О атомы связаны тройной связью: две из этих связей
образованы по обменному механизму, а третья — по донорно-акцепторному.
Теория Льюиса позволяет не только описать распределение электронов в молекулах, но и рассчитать так называемые эффективные заряды на
атомах. Для этого электронный «колхоз» временно «разгоняют»,
электроны, участвующие в химической связи, делят поровну между атомами,
подсчитывают общее число электронов каждого атома и сравнивают его с
числом валентных электронов до образования связи. В молекуле СО на долю
углерода приходится пять электронов (два своих и три из шести общих),
тогда как в свободном атоме углерода — четыре электрона. Лишний
электрон означает, что эффективный заряд на атоме углерода в молекуле СО равен -1. Молекула в целом электронейтральна, поэтому заряд на атоме кислорода равен +1.
Силы, действующие в молекулярном ионе H+2 при его образовании из атомов.
Следует
заметить, что истинные заряды на атомах почти всегда меньше
эффективных. Так, в молекуле НС1 эффективные заряды атомов Н и Сl равны
+1 и -1, а истинные (определённые методами рентгеновской
спектроскопии) соответственно +0,2 и -0,2. Чем ближе истинные заряды к
эффективным, тем сильнее проявляется ионный характер связи.
Источник: энциклопедии по химии
ресурсы Интернет
https://murzim.ru/nauka/himiya/19749-teoriya-lyuisa.html
Источник: энциклопедии по химии
ресурсы Интернет
https://murzim.ru/nauka/himiya/19749-teoriya-lyuisa.html

Комментариев нет:
Отправить комментарий
Примечание. Отправлять комментарии могут только участники этого блога.